Si dispones del manual en papel y te apetece, puedes hacer una foto de las figuras con peor calidad y lo cambiamos. .
La prescripción de los antipsicóticos en la práctica clínica puede ser muy diferente de su estudio en ensayos clínicos. Los pacientes reales son a menudo más complicados, muchos tienen diagnósticos que no cumplen criterios diagnósticos para las indicaciones formalmente estudiadas, y en general tienen mucha más comorbilidad que los pacientes estudiados en los ensayos clínicos. Además, las dosis óptimas sugeridas en los ensayos clínicos no son a menudo las mismas dosis óptimas empleadas en la práctica clínica (demasiado altas para algunos fármacos; demasiado bajas para otros).
Listado de los antipsicóticos (según su patrón de actividad)
Con patrón típico: Antipsicóticos clásicos o neurolépticos:
- Clorpromacina (droga patrón): Primer antipsicótico, de perfil sedativo.
- Tioridazina: neuroléptico de transición, potencial cardiotóxico por encima de ciertas dosis.
- Tiotixeno: Neuroléptico que actúa fundamentalmente por bloqueo D2.
- Zuclopentixol: Derivado del tioxanteno, tiene un efecto calmante específico y antipsicótico pronunciado. Se puede aplicar en su forma depot en pacientes con dificultad para sostener el tratamiento de modo continuo. Las preparaciones de depósito se mantienen activas durante semanas cada vez que se aplican, por lo que se utilizan con frecuencia para los pacientes a los que les resulta difícil o rehúsan tomar regularmente la medicación por vía oral. Los datos que ofrecen los ensayos han mostrado resultados muy favorables a esta preparación.
- Trifluoperazina: Fármaco antipsicótico que se utiliza desde los años ´50 para tratar la esquizofrenia. Muy efectivo para los síntomas positivos de psicosis.
- Levomepromazina: Antipsicótico que se utiliza fundamentalmente para aprovechar su perfil sedativo.
- Flufenazina: Antipsicótico de administración oral o intramuscular.
- Haloperidol: Potente antipsicótico típico. Se puede administrar en comprimidos, gotas, por vía parenteral en su forma de depósito o por vía intravenosa en urgencias.
- Molindona: Fármaco antipsicótico anterior con un perfil farmacodinámico parecido a la quetiapina. Comparada con otros típicos no muestra diferencias en cuanto a la efectividad y la probabilidad de causar SEP. Sin embargo, causa significativamente más pérdida de peso. No existen en la actualidad pruebas para sugerir que pueda tener un perfil atípico.
- Pimozida: Utilizado en pacientes con esquizofrenias con síntomas negativos o residuales. Produce escasa sedación. Ha mostrado capacidad para favorecer el contacto social, la motivación y la iniciativa. Tendría acción sobre los receptores aminérgicos centrales.
Con patrón atípico: Antipsicóticos atípicos:
- Clozapina: Primer atípico. Presenta riesgo de agranulocitosis que obliga a monitoreo hematológico continuo sistemático.
- Risperidona: Atípico en dosis bajas, funciona como típico al incrementarlas. Primer atípico que tuvo inyección de depósito.
- Olanzapina: Parecida a clozapina, alta efectividad y alto riesgo cardio – metabólico.
- Quetiapina: dúctil, cambia el perfil de acción a distintas dosis.
- Zotepina: Bloqueo 5HT2A – D2 y también inhibe la recaptación de NA, lo cual explica la acción antidepresiva.
- Ziprasidona: muy bajo riesgo cardiometabólico. Vida media corta.
- Sertindol: Antagonista 5HT2A – D2 Fue aprobado para ser prescripto en Europa pero cayó en desuso por el riesgo de producir severas y peligrosas arritmias cardíacas. Fue reintroducido en algunos países como fármaco de segunda línea cuando fallan otras drogas pero requiere estricto monitoreo del funcionamiento cardíaco y de la posible interacción con otras drogas.
- Raclopride: Modula los sistemas dopaminérgicos y serotoninérgicos.
- Loxapina: problemático para el modelo antagonista 5HT2A– D2 ya que a pesar de cumplir con esta característica de atipía en la clínica produce SEP con más frecuencia de lo esperable. Tal vez relacionado con su metabolito activo amoxapina, que adiciona bloqueo D2.
- Aripiprazol: Agonista parcial D2, bajo perfil cardiometabólico.
- Paliperidona: Metabolito activo de risperidona, con pocas interacciones medicamentosas; no tiene metabolismo hepático. Su eliminación depende puramente de la excreción renal.
- Asenapina: molécula parecida al antidepresivo mirtazapina, de administración sublingual por el fuerte efecto de primer paso hepático.
- Lurasidona: Iguala en eficacia a la olanzapina con menor perfil de efectos adversos cardio – metabólicos.
- Iloperidona: Junto con quetiapina, son los que tienen menos probabilidad de producir SEP.
- Perospirona: Antagonista 5HT2A – D2. Agonista parcial sobre 5HT1A. Aprobado en Japón. Se administra tres veces al día. Hay pocos estudios sobre los efectos colaterales. Más usado para la esquizofrenia que para la manía.
- Sulpirida: Desarrollado en Europa, es uno de los primeros. En dosis altas puede producir SEP e hiperprolactinemia. Es activante, lo cual le confiere utilidad sobre los síntomas negativos. Preferencia por D3. Agonista parcial sobre D2, pero en dosis altas funciona como antagonista D2.
- Amisulprida: Como sulpirida, fue desarrollada en Europa. Agonista parcial D2 con perfil farmacodinámico más próximo al antagonismo D2. Antagonista 5HT7. En dosis bajas actúa sobre síntomas negativos y depresivos. En dosis altas produce SEP e hiperprolactinemia.
- Brexpiprazol: Molécula muy nueva, con bastante parecido al aripiprazol.
- Cariprazine: Droga en estudio. Afinidad por D3.
El arte de cambiar de antipsicóticos
Cambiar de un antipsicótico ha demostrado ser problemático para muchos pacientes. El cambio de antipsicóticos requiere la habilidad de cambiar al paciente en sí. De otra forma, puede desarrollar agitación, activación, insomnio, psicosis de rebote y efectos de abstinencia, especialmente rebote anticolinérgico si se hace demasiado rápido o sin delicadeza; esto es particularmente evidente cuando se intenta detener de manera abrupta un antipsicótico e introducir el otro a plena dosis.
CÓMO CAMBIAR DE ANTIPSICÓTICO
- No interrumpir de forma abrupta el primer antipsicótico.
- No permitir desfases entre la administración de los dos antipsicóticos.
- Iniciar el segundo antipsicótico a plena dosis.

Cómo NO cambiar de antipsicóticos. Pasar a los pacientes de un antlpsicótico a otro requiere mucho cuidado para garantizar que no desarrollen síntomas de abstinencia, psicosis de rebote o agravamiento de los efectos secundarios. Generalmente, esto significa no interrumpir de forma abrupta el primer antipsicótico, no permitir desfases entre la administración de los antipsicóticos e iniciar el segundo antipsicótico a plena dosis.
AJUSTE CRUZADO
- Al cambiar de un antipsicótico a otro, se reduce la dosis el primer fármaco a la vez que se aumenta la dosis del otro a lo largo de unos días o semanas.
- Administración transitoria de los dos fármacos para evitar efectos secundarios o síntomas de rebote.
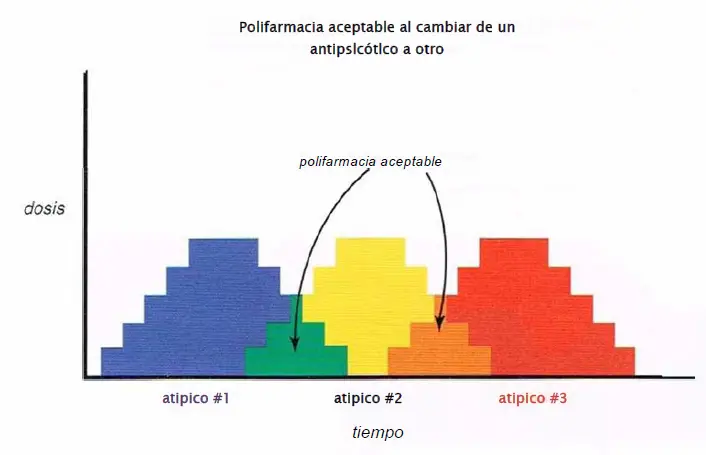
Cambio de un antipsicótico a otro. Cuando se cambia de un antipsicótico a otro, normalmente es prudente hacer un «ajuste cruzado», es decir, reducir la dosis del primer fármaco a la vez que se aumenta la dosis del otro a lo largo de unos días o semanas. Esto supone una administración transitoria de los dos fármacos, pero está justificado para reducir efectos secundarios y el riesgo de síntomas de rebote y acelerar la transición con éxito al segundo fármaco.
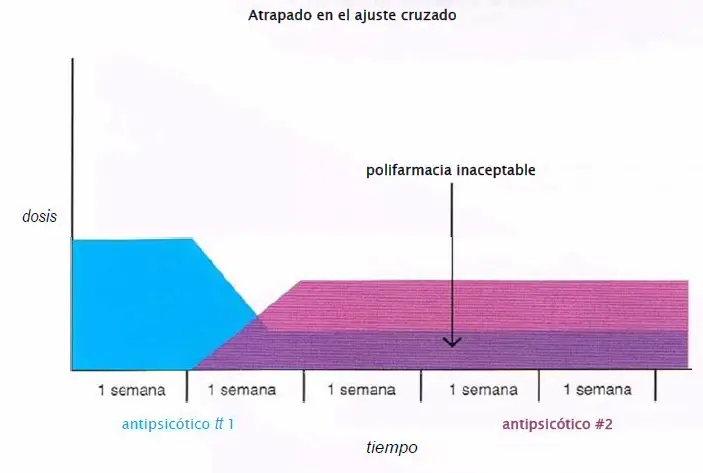
Atrapado en el ajuste cruzado. Cuando se cambia de un antipsicótico atípico a otro, el paciente podría mejorar en el transcurso de un ajuste cruzado. Se produce polifarmacia si el ajuste cruzado es detenido en este punto y el paciente continúa con ambos fármacos indefinidamente. Generalmente, es mejor completar el ajuste cruzado, con interrupción del primer agente y un ensayo adecuado de monoterapia con el segundo fármaco antes de tener que intentar una polifarmacia a largo plazo.
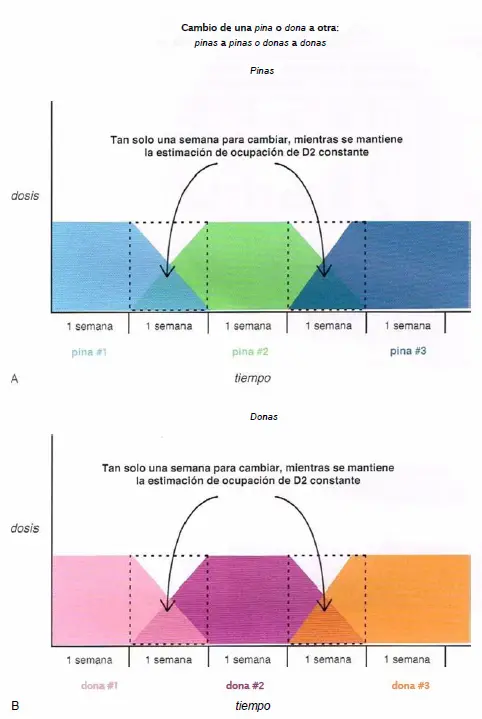
Cambio de una pina o dona a otra.
- (A) Cuando se cambia de una pina (clozapina, olanzapina, quetiapina, asenapina) a otra, es prudente hacer el cambio en tan solo una semana, mientras se mantiene constante la estimación de ocupación del receptor D2.
- (B) Del mismo modo, cuando se cambia de una dona (risperidona, paliperidona, ziprasidona, iloperidona, lurasidona) a otra, es prudente hacer el cambio en tan solo una semana, mientras se mantiene constante la estimación de ocupación del receptor D2.
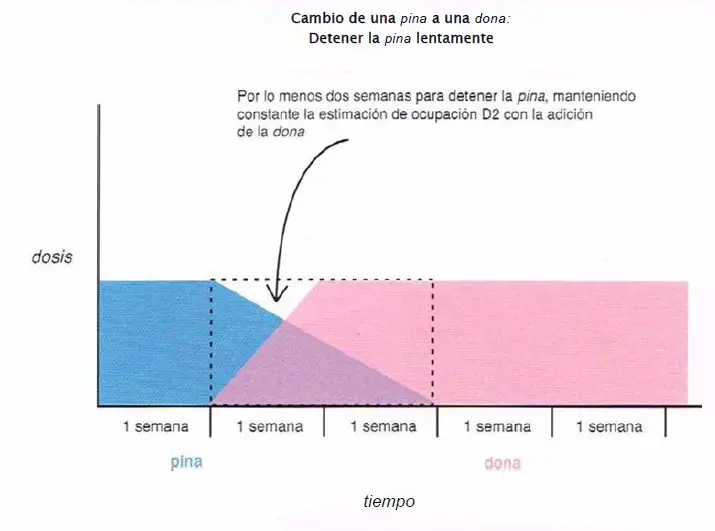
Cambio de una pina a una dona. Cuando se cambia de una pina (clozapina. olanzapina, quetiapina, asenapina) a una dona (risperidona, paliperidona, ziprasidona, iloperidona, lurasidona), es prudente emplear por lo menos dos semanas para detener la pina, mientras se mantiene constante la estimación de ocupación del receptor D2 durante la adición de la dona.
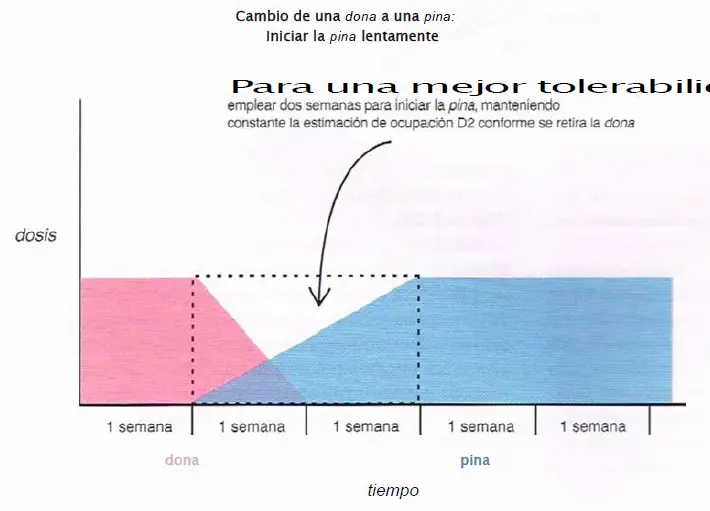
Cambio de una dona a una pina. Cuando se cambia de una dona (risperidona, paliperidona, ziprasidona, iloperidona, lurasidona) a una pina (clozapina, olanzapina, quetiapina, asenapina), se puede obtener una mejor tolerabilidad si se ajusta la pina al alza a lo largo de dos semanas, mientras se mantiene constante la estimación de ocupación D2 conforme se retira la dona.
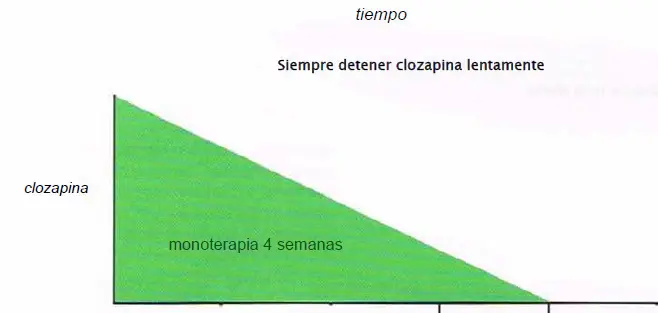
Retirada de Clozapina
- Se retira lentamente, con 4 semanas de ajuste a la baja antes de comenzar con otro antipsicótico.
Cambio a aripiprazol
Cambio desde una –pina a Aripiprazol
- Comenzar con una dosis media de aripiprazol.
- Establecer la dosis efectiva de aripiprazol en 3-7 días.
- Ajustar a la baja la –pina lentamente en 2 semanas.
Cambio desde una –dona a Aripiprazol
- Iniciar aripiprazol a dosis media.
- Ajustar a la baja la –dona durante 1 semana.
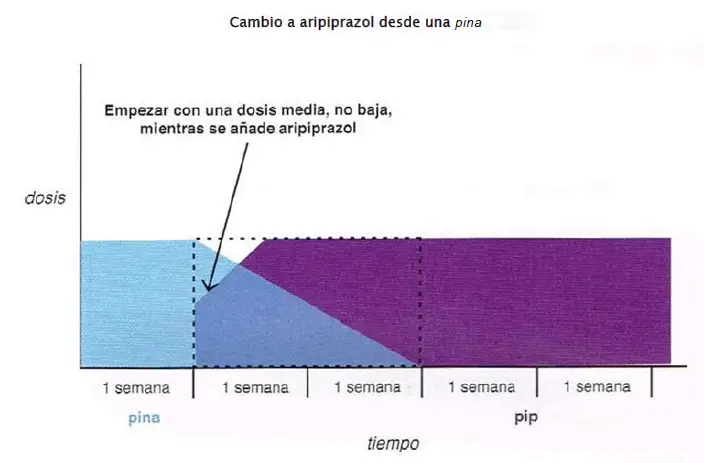
Cambio a aripiprazol desde una pina. El aripiprazol tiene mayor afinidad a los receptores D2 que la mayoría de pinas (clozapina, olanzapina, quetiapina, asenapina); así, los síntomas irruptivos a pesar de la medicación son más probables cuando se cambia desde una pina al aripiprazol. Una estrategia prudente, por tanto, es empezar con el aripiprazol a una dosis media, más que con una dosis baja, mientras se ajusta a la baja la pina lentamente durante dos semanas
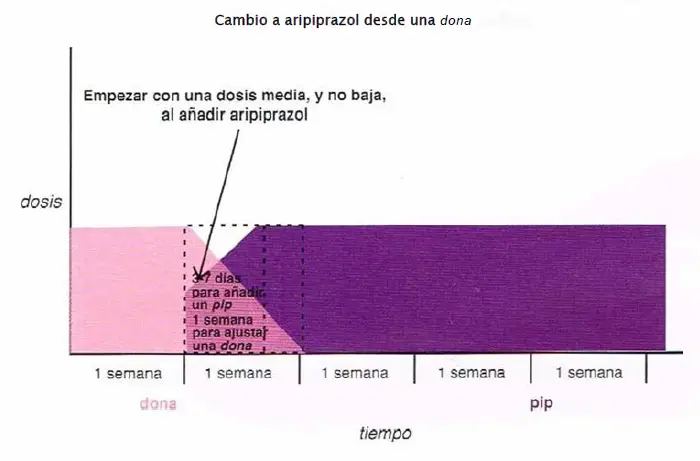
Cambio a aripiprazol desde una dona. Cuando se hace el cambio de aripiprazol desde una «dona» (risperidona, paliperidona, ziprasidona, iloperidona, lurasidona), se recomienda iniciar el aripiprazol a una dosis media, más que baja, mientras se ajusta a la baja la dona durante una semana.
Cambio desde aripiprazol
Cambio desde aripiprazol a una -dona
- Retirar el aripiprazol inmediatamente.
- Comenzar con la –dona a dosis media.
- Ajustar al alza la –dona durante 1 semana.
Cambio desde aripiprazol a una -pina
- Retirar el aripiprazol inmediatamente.
- Comenzar con la –pina a dosis media.
- Ajustar al alza la –pina durante 2 semanas.
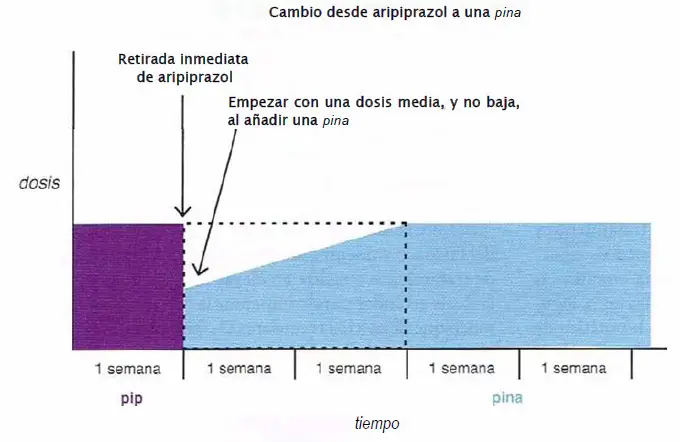
Cambio desde aripiprazol a una pina. Cuando se cambia desde aripiprazol a una pina (clozapina, olanzapina, quetlapina, asenapina), se recomienda detener aripiprazol inmediatamente y comenzar con la pina a una dosis media, más baja. La pina puede ser ajustada al alza durante dos semanas.
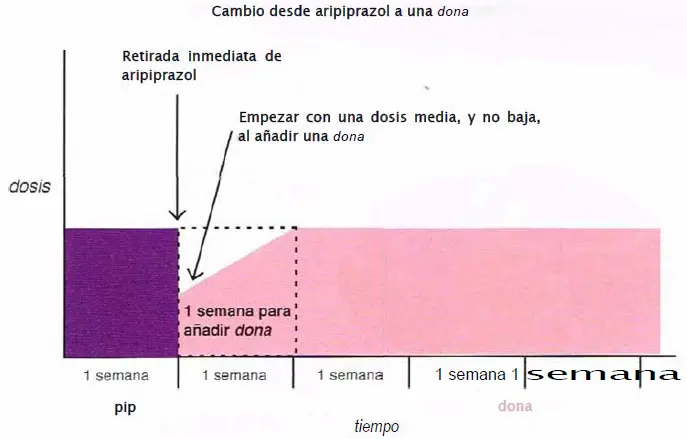
Cambio de aripiprazol a una dona. Cuando se cambia desde aripiprazol a una dona (risperidona, paliperidona, ziprasidona, iloperidona, lurasidona), se recomienda retirar el aripiprazol Inmediatamente y comenzar con la dona a dosis media, más que baja. La dona puede ser ajustada al alza durante una semana.
Resistencia al tratamiento y violencia
Cuando el antipsicótico no funciona suele denominarse psicosis resistente al tratamiento y suele caracterizarse por delirios, alucinaciones y trastorno del pensamiento; es decir, síntomas predominantemente positivos que no responden a dosis estándar de varios ensayos con antipsicóticos convencionales o atípicos individuales.
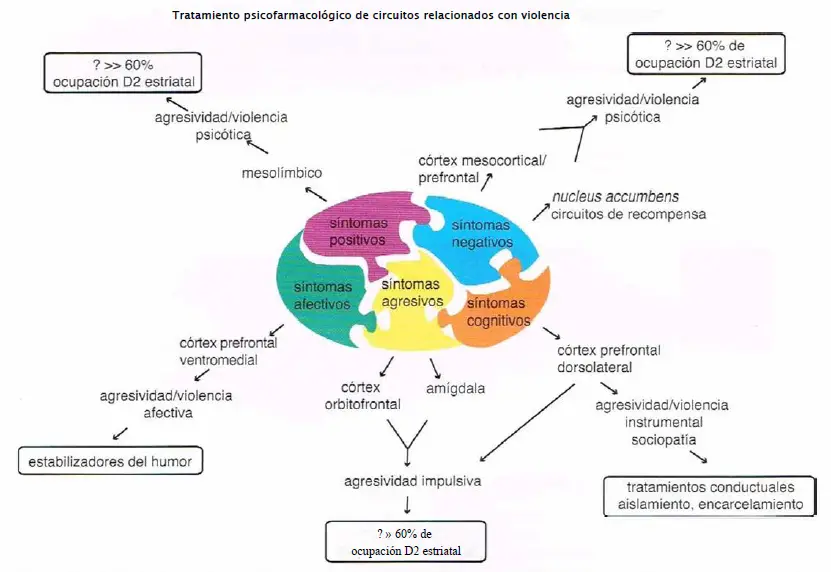
Tratamiento psicofarmacológico de circuitos relacionados con violencia. La conducta violenta puede estar relacionada con circuitos que son relevantes para la esquizofrenia, y por tanto puede ser atacada con estrategias psicofarmacológicas que actúan sobre esos circuitos. Las vías mesolímbicas y mesocorticales, en teoría responsables de los síntomas positivos y negativos, también pueden intervenir en la agresividad y la violencia. Es posible que agentes que buscan una ocupación del receptor D2 muy por encima del 60% puedan reducir estos síntomas. Del mismo modo, el córtex orbitofrontal y la amígdala podrían desempeñar un papel relevante en la agresividad impulsiva, que teóricamente sería aliviado mediante agentes que busquen una ocupación del receptor D2 muy por encima del 60%. Los síntomas afectivos que pueden contribuir a una conducta violenta podrían ser mediados por el córtex prefrontal ventromedial y serían potencialmente tratados con estabilizadores del humor. Finalmente, la agresividad instrumental y la sociopatía violenta pueden ser mediadas por el córtex prefrontal dorsolateral y probablemente sería mejor gestionada con estrategias conductuales, incluyendo aislamiento y encarcelación.
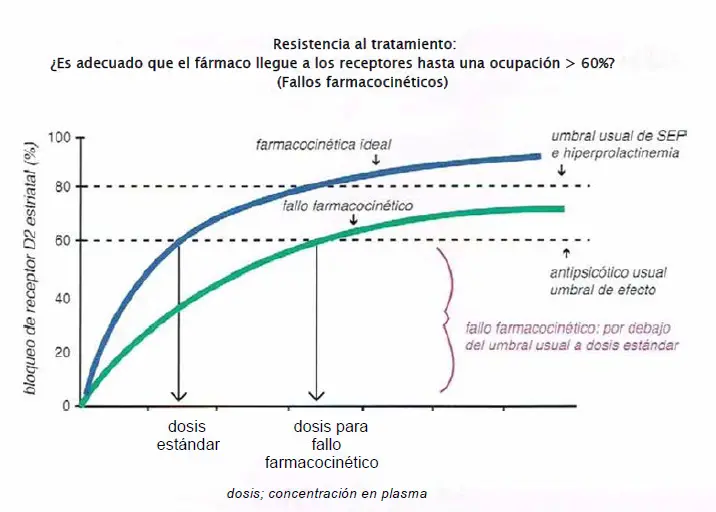
Resistencia al tratamiento o fallo farmacocinético. En general, es necesaria una ocupación del receptor D2 superior al 80% en la vía mesolímbica para lograr efectos antipsicóticos, mientras que una ocupación D2 por encima del 80% en el estriado dorsal está relacionada con efectos secundarios extrapiramidales (SEP) y una ocupación de D2 superior a 80% en la pituitaria está relacionada con la hiperprolactinemia. Sin embargo, aunque la mayoría de pacientes podrían alcanzar una ocupación del 80% del receptor D2 en la mesolímbica vía y un 60% de ocupación del receptor D2 en el estriado con dosis estándar de antipsicóticos, esto podría no ser así para todos los pacientes. Es decir, los factores farmacocinéticos podrían influir en hasta qué punto el fármaco alcanza el receptor objetivo. Por ejemplo, los individuos con ciertas variantes del CYP450 podrían ser rápidos metabolizadores de determinadas medicaciones y así nunca llegar a una ocupación adecuada del receptor D2 con la dosis estándar. También pueden darse bajos niveles de fármaco debido a una mala absorción del fármaco, lo que sería el caso en pacientes con bypass gástrico, bandas gástricas, colectomías, o por motivos desconocidos. La comida también puede afectar a la absorción de ciertos antipsicóticos. Si la dosificación estándar alcanza menos de un 80% de ocupación del receptor D2 en la región mesolímbica o 60% de ocupación del receptor D2 en el estriado, esa dosis podría no ser efectivo independientemente de cuántos fármacos se prueben. Llegados a ese punto, podríamos sospechar fallo farmacocinético para pacientes que no responden a una secuencia de monoterapias y que además no tienen efectos secundarios. Esto se puede confirmar midiendo los niveles terapéuticos del fármaco; si se confirma, estaría justificado emplear una dosis por encima de lo normal.
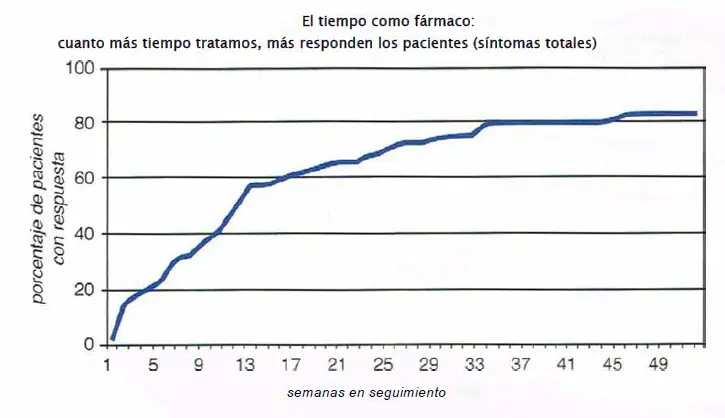
El tiempo como fármaco. Puede ocurrir que el mantenimiento de un paciente con la misma medicación durante un amplio periodo de tiempo, en lugar de cambiar cada poco, de lugar a una mejora adicional en los síntomas.

Falta de respuesta/violencia: tratamiento muy prolongado usando el tiempo como fármaco. Es posible que algunos pacientes experimenten fallos farmacodinámicos. Para esos pacientes, podría ser que los efectos posteriores del bloqueo de D2 necesiten más tiempo para manifestarse que las típicas seis semanas asignadas para un ensayo del fármaco. Para estos individuos, el tiempo en sí mismo puede ser un tratamiento terapéutico.
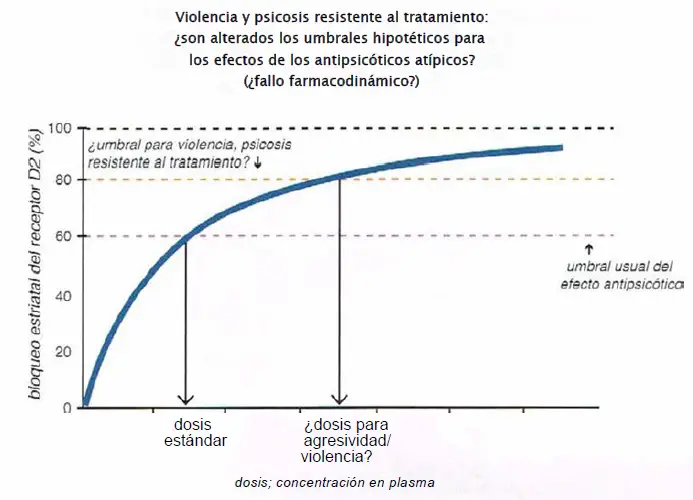
No respuesta/violencia: ¿son alterados los umbrales hipotéticos para los efectos del fármaco? Es posible que algunos pacientes experimenten fallo farmacodinámico. Para esos pacientes, puede ser necesario más de un 80% de ocupación del receptor D2 en la vía mesolímbica para lograr efectos terapéuticos. Esto puede ser cierto particularmente para pacientes que no han logrado responder a múltiples agentes, adecuadamente dosificados y que siguen presentando agresividad o violencia. Es posible que, para estos pacientes, sea necesario el uso de altas dosis que logren una ocupación límbica del 80%-100% del receptor D2 para obtener efectos terapéuticos.
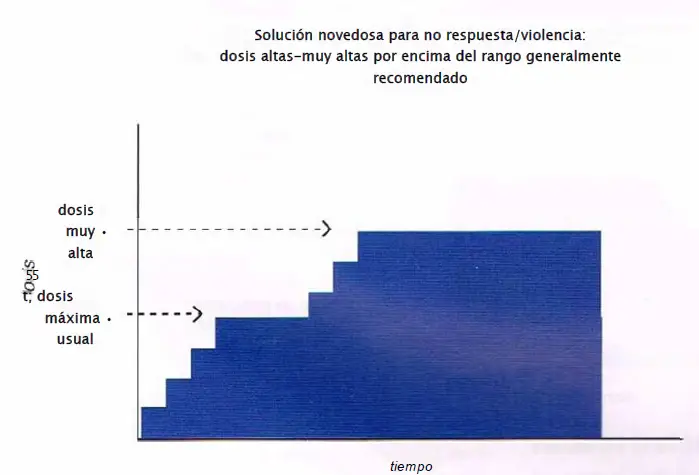
No respuesta/violencia: dosis altas-muy altas. Los pacientes que no han logrado responder a múltiples agentes adecuadamente dosificados y que tienen agresividad o violencia podrían tener fallo farmacodinámico y requerir dosis en un 80%-100% de ocupación estriatal del receptor D2. Por tanto, podrían requerir una dosis superior al rango generalmente recomendado. La base de evidencia para monoterapia en altas dosis varía para los diferentes antipsicóticos atípicos y hay ciertos agentes para los que podría no estar indicada.
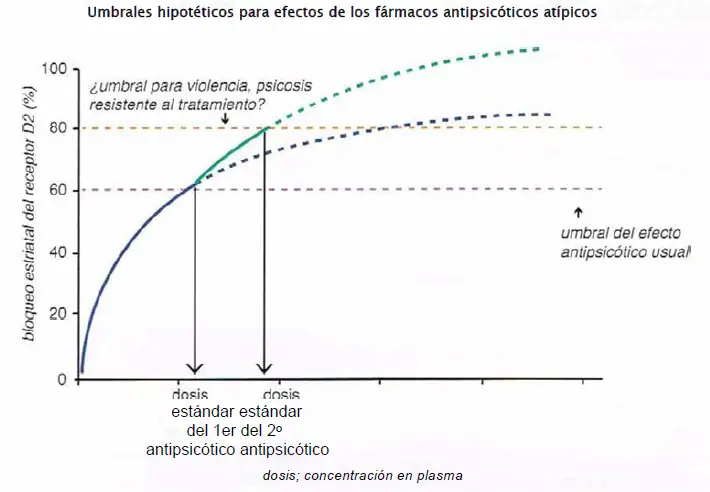
No respuesta/violencia: umbrales hipotéticos para efectos del fármaco. Los pacientes que no han logrado responder a múltiples agentes, adecuadamente dosificados y que tienen agresividad o violencia, podrían tener fallo farmacodinámico y requerir 80%-100% de ocupación límbica del receptor D2. Esto se puede lograr potencialmente añadiendo una dosis estándar de un segundo antipsicótico a una dosis estándar del primer antipsicótico.
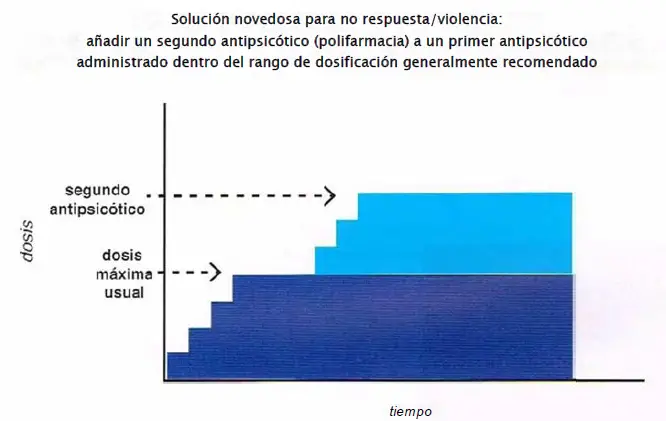
No respuesta/violencia: polifarmacia. Los pacientes que no han logrado responder a múltiples agentes adecuadamente dosificados y que tienen agresividad o violencia pueden tener fallo farmacodinámico y requerir una ocupación estriatal de 80%-100% del receptor D2. Esto se puede conseguir potencialmente añadiendo una dosis estándar de un segundo antipsicótico a una dosis estándar del primer antipsicótico. Esta estrategia no está bien estudiada y en realidad debería quedar reservada para casos en los que falla todo lo demás.
Resistencia al tratamiento / Violencia
- Psicosis resistente al tratamiento: síntomas predominantemente positivos que no responden a dosis estándar de varios ensayos con antipsicóticos convencionales o atípicos individuales.
- uso de CLOZAPINA (hay casos en que no se recomienda su uso o no es efectiva)
Causas de la resistencia / violencia
- Fallos farmacocinéticos: absorción, distribución, metabolismo y eliminación.
- No hay ocupación del 60% receptores D2 en el estriado ni del 80% en mesolímbico.
- No hay efecto terapéutico ni efectos secundarios.
- Medir niveles plasmáticos del fármaco.
- Aumentar la dosis del fármaco.
- Fallos farmacodinámicos: no logran respuesta clínica a pesar de la adecuada ocupación de receptores D2. Posibles causas:
- Perturbación afectiva: añadir estabilizador del ánimo o antidepresivo.
- Lenta respuesta a la ocupación del receptor D2: dar más tiempo para esperar la respuesta (“el tiempo como fármaco”).
- Necesitan más del 60% ocupación de los receptores D2 estriatales: usar dosis muy altas de un fármaco o polifarmacia a dosis estándar, midiendo riesgo/beneficio.
- Agresividad instrumental en sociopatía o trastorno de personalidad antisocial: tratamiento conductual, aislamiento o encarcelamiento.
Psicoterapia y esquizofrenia
Cada vez queda más claro que las psicoterapias pueden ser combinadas con antipsicóticos para impulsar la efectividad de estos agentes. La integración de psicofarmacología y psicoterapia en trastornos psicóticos es un área de interés creciente y progreso en investigación y se incluye en muchas directrices de tratamiento para la esquizofrenia.
Psicoterapia y esquizofrenia
- En combinación con antipsicóticos.
- Terapia cognitivo-conductual: ejercicios mentales y autoobservación.
- Apoyo familiar y externo: interacciones sociales positivas.
- Programas comunitarios de tratamiento: rehabilitación y mantenimiento de empleo.
- Terapias de motivación: participación activa del paciente.
- Terapia de rehabilitación cognitiva: tareas informatizadas.
REFERENCIAS
- Stahl, S., & Muntner, N. (2016). Psicofarmacología esencial de Stahl : Bases neurocientíficas y aplicaciones prácticas (4ª ed.; Ed. especial para alumnos de la UNED. ed., Aula Médica Formación en Salud). Madrid: Aula Médica.
- PowerPoint Profesora Alicia Ferrer Vadell
- Antipsicóticos. Silvia Herlyn
- YouTube

